- 안티트롬빈 표적 RNAi 치료제인 피투시란, 환자를 대상으로 안전성 시험
미국의 RNAi 치료제 전문 기업인 아닐람 제약(Alnylam Pharmaceutical)과 사노피 제약(Sanofi)이 공동 개발 중인 혈우병 치료제 피투시란(Fitusiran)의 국내 임상이 진행 중인 것으로 알려졌다. 피투시란은 안티트롬빈(antithrombin) 표적 RNAi 치료제 후보물질로 A, B형 혈우병 환자의 치료제로 개발된 제품이다.
 |
||
| ▲ 아닐람의 피투시란은 2006년 앤드류 Z. 파이어와 크레이그 C. 멜로 박사의 이중나선 RNA에 의한 RNA 간섭 발견으로 노벨상을 받은 기술로 제작된다. | ||
식품약품안전처는 지난 4월 11일 및 18일, 연구 개발 수탁 전문기업(CRO)인 파마슈티컬 프로덕트 디벨롭먼트(PPD)의 피투시란 임상 3상 시험 세 건을 승인한 바 있다. 이 치료제의 임상시험은 연세대학교 세브란스병원, 을지대학교병원, 강동경희대학병원, 부산대학교병원에서 진행되고 있으며 8, 9인자 항체환자 및 항체가 없는 환자에게 피투시란의 안전성, 유효성을 평가하기 위하여 실시된다.
 |
||
| ▲ 식품의약품안전처의 피투시란 임상시험 승인 내역, 총 3가지의 방식으로 각 대학병원을 통해 진행된다. | ||
ATLAS-INH로 명명된 임상시험에서는 8, 9인자의 항체가 있는 혈우병 환자에게 피투시란의 안전성과 유효성을 위하여 실시되며, ATLAS-PPX 임상시험은 과거 예방 우회제제를 투여받고 있는 항체 환자에 대하여 피투시란의 예방적 사용의 안전성과 유효성을 확인하기 위하여 시행된다. 마지막으로 ATLAS-A/B 임상시험은 항체가 없는 A 또는 B형 혈우병 환자에게 피투시란의 안전성과 유효성을 평가하는 3상 시험이다.
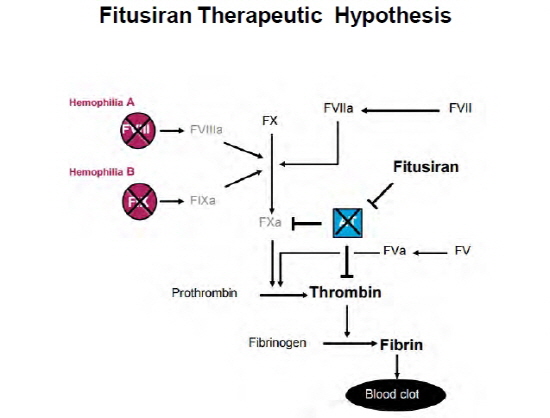
아닐람 제약이 개발하고 있던 피투시란은 지난 2016년 사노피 제약이 미국과 캐나다, 서유럽에서의 혈우병 및 희귀 출혈질환에 대한 치료제로 공동 개발 및 상업화에 공동 개발하기로 한 제품이다. 이 치료제는 출혈 예방과 지혈을 위하여 안티트롬빈 수치를 낮춰 트롬빈 생성을 촉진하여 출혈을 막는 방식의 치료제이다.
 |
||
| ▲ 아닐람 홈페이지의 피투시란 약품 개발 단계, 현재 3상 임상을 전 세계적으로 시행 중이다. | ||
하지만 이 안티트롬빈 표적 치료 방법은 미국, 캐나다 및 일본에서 사용 승인이 발표되어 빠른 속도로 확장 영역을 넓히고 있는 헴리브라(hemlibra, emicizumab)와 마찬가지로 지난해 2분기 미국 내에서 2상 임상시험 도중 환자 한 명이 뇌혈전색전증으로 사망하면서 모든 연구들이 중단된 바 있다. 이후 아닐람은 돌발 출혈 치료를 위한 대체 인자 또는 우회제제의 용량 감소와 관련된 연구자 및 환자에 대한 교육과 프로토콜 가이드라인을 비롯한 새로운 임상 위험 경감 조치를 마련하여 미 FDA와 조정에 들어갔고 이러한 절차를 FDA가 승인하면서 임상시험이 재개되었다.
 |
||
| ▲ 피투시란이 혈전을 만들어 출혈을 막는 방법을 나타낸 모식도 | ||
피투시란에 대한 전 세계적 개발 및 상용화에 대한 권리는 사노피 제약이 가지고 있으며 국내에서 임상시험이 완료되어 사용 승인이 날 경우 젠자임 코리아(사노피 젠자임의 국내사업부)를 통해 판매될 것으로 보인다.
[헤모라이프 황정식 기자]
황정식 기자 nbkiller@hanafos.com
